エントロピーはなぜ対数なのか
エントロピーは複雑性の対数である。定性的にはエントロピーは、複雑性と同様に、不確定性、乱雑さ、無秩序の度合いであるのだが、定量的には対数であるから、複雑性とは同じではない。一般的に言って、私たちの感覚は、刺激の物理量そのものよりもその対数に比例する。だから、一見私たちの感覚を超越した抽象的な概念と思われるエントロピーも、実は私たちの感覚の本性に忠実な尺度であると言うことができる。
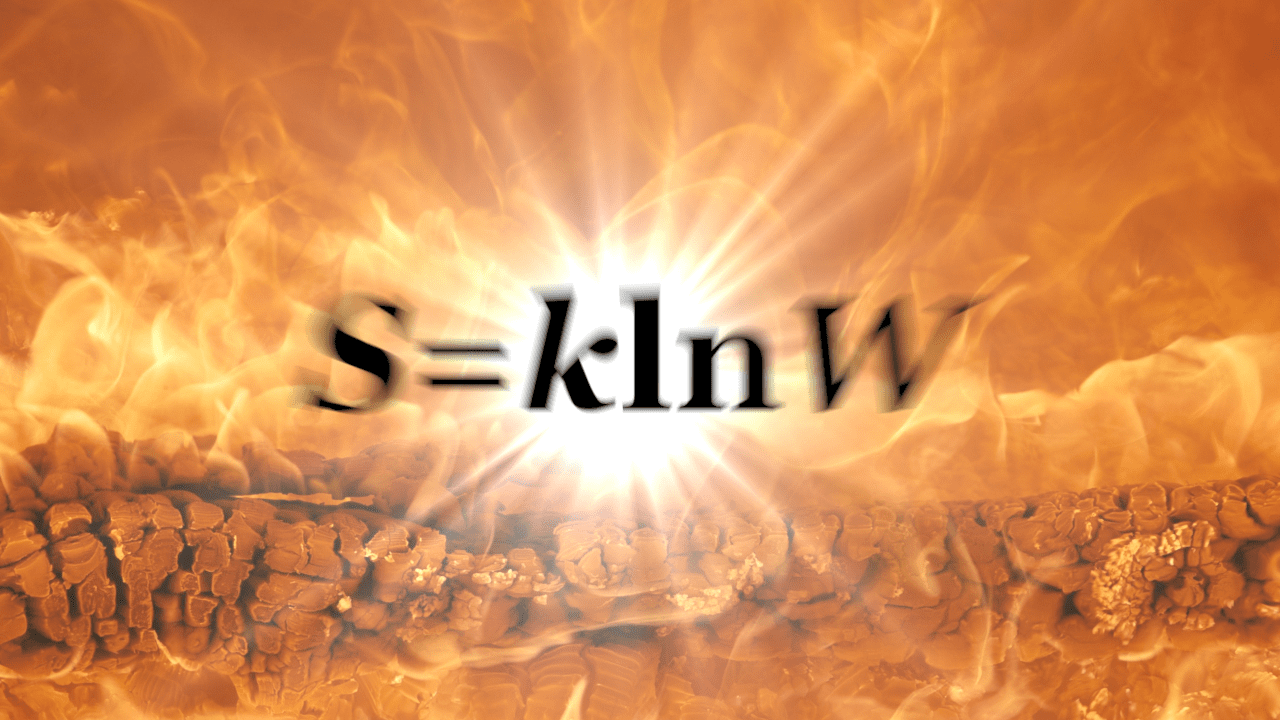
1. エントロピーの熱力学的な定義
エントロピー(ドイツ語:Entropie)という言葉は、1865年にドイツのクラウジウスがエネルギーに倣って創った言葉である[1]。“en”は「中に」という意味のギリシャ語の前置詞"ἐν"に 、“tropie”は「変化」を意味するギリシャ語"τροπή" に由来する。だから、エントロピーとは「変化に内在するもの」という意味である。これに対して、エネルギー(Energie)は、「仕事」を意味するギリシャ語"ἔργον"に同じ前置詞を付けて形成された。したがって、語源的には
- エネルギー=仕事の本質
- エントロピー=変化の本質
ということである。変化といっても、クラウジウスが念頭に置いているのは熱力学的な変化である。すなわち、高温のシステムと低温のシステムが接すると、熱の移動が起き、両方のシステムで変化が起きる。そして、この変化の中において、エントロピーが増大する。
あるシステム(系)が、高温の環境に接すると、熱は環境からシステムに移り、システムは高温となる。このとき受け取った熱量(単位ジュール)をシステムの絶対温度(単位ケルビン)で割った商がエントロピーである。例えば、1気圧のもとで、336Jの熱を加えて1gの氷を溶かすと、エントロピーは、336J/273K=1.23増加する。
なぜ分母にシステムの温度が必要かというと、それは、エントロピーが、私たちの乱雑さに対する感覚を忠実に数量化するためである。0℃の水100グラムに100℃の水10グラムを加えた時と90℃の水100グラムに100℃の水10グラムを加えた時では、乱雑になった度合いが違うのである。
比喩(後で説明するように、たんなる比喩ではない)を使うならば、買ったばかりの新しい単色のじゅうたんに誤って一滴のインクをこぼしたことによって生じる乱雑さの感覚上の増加は、長年使い古し、あちこちに擦り切れてはげた部分やらコーヒーをこぼしてできたしみやら家具を置いてへこんだ跡やらがあるじゅうたんに落とされた同量のインクがもたらす乱雑さの感覚上の増加量よりもずっと大きい。
エントロピーは、受け取った熱量をシステムの絶対温度で割った商であるが、氷が溶けるといった特殊な場合以外は、熱量を受け取っている間にシステムの温度が変化してしまうので、普通は単純な割り算では求められない。そこで、微分式
エントロピーの微小増加量=受け取った微小熱量/システムの温度
を作って、これを積分する。ここで言う微小量とは限りなくゼロに近い量だから、システムの温度に影響を与えない。
2. 熱エントロピーと物エントロピー
システムが受け取る熱エネルギーは、エネルギー保存則(熱力学第一法則)により、システムの内部エネルギーを増やすか外部に仕事をするかどちらかに変換される。両方に変換される場合もあるが、積分する際の変数を一つにするために、外部に仕事をしない場合と内部エネルギーを増やさない場合に分けて考えよう。
[ケース1] 熱を加えた結果、体積一定のまま、温度が"温度低"から"温度高"に変化する場合→温度で積分→エントロピーの増加量は、温度高/温度低の対数に比例する。
[ケース2] 熱を加えた結果、温度一定のまま、体積が"体積小"から"体積大"に変化する場合→体積で積分→エントロピーの増加量は、体積大/体積小の対数に比例する。
ケース1で増加するエントロピーは熱エントロピーと呼ばれ、ケース2で増加するエントロピーは物エントロピーと呼ばれる。前者では、分子の運動が活発になることにより、後者では分子の存在領域が拡大することにより、いずれも気体分子の場合の数(複雑性)が増大する。場合の数が増大すると、分子が特定の配置に存在する確率が減る、つまり分子の存在の不確定性が増大する。
温度高/温度低にしても、体積大/体積小にしても、真数である複雑性の増加率が1より大きいので、エントロピーの増加量は必ずプラスとなる。環境との間に熱や物の出入りがないシステム(孤立系)においては、エントロピーは増えることはあっても減ることは絶対無い。これをエントロピー非減少の法則という。ただし、孤立系のサブシステムである非孤立系では、エントロピーが減ることがある。しかしそのサブシステムの環境では、それ以上のエントロピーが増大するので、全体としては、エントロピーは増大する。
3. 複雑性とエントロピーの違い
ここで、エントロピーは、複雑性ではなくて複雑性の対数に比例することに注目して欲しい。これも、エントロピーが私たちの感覚に忠実な数量であることを示している。フェヒナーの法則によれば、私たちの感覚は、刺激の対数に比例する。つまり刺激の大きさが3から6に倍増しても、私たちは刺激が2倍になったとは感覚しない。3から9(3の2乗)になってはじめて、2倍になったと感覚する。
もう一度じゅうたんの例に戻って、私たちの感覚が非線形であることを確認しよう。買ったばかりの新しい単色のじゅうたんに誤って落とされた最初のインク一滴は悲鳴ものの悲劇だが、その後さらにもう一単位しみの複雑性が増えても、それは最初の時ほど悲劇ではない。汚れが増えるにつれて、私たちの乱雑さに対する感覚は麻痺してくる。これを限界エントロピー逓減の法則と名付けることにしよう。
このような名前を付けるのは、他でもない、これが経済学ではおなじみの限界効用逓減の法則と同じであるからだ。限界効用逓減の法則とは、例えば空腹のとき、一単位目の食物はおいしいが、二単位目はそれほどでもなく、三単位目はさらにありがたみが減るというように、追加される商品一単位ごとにその効用の増加率が減っていくという法則である。
「価値とは何か」で述べたように、経済的価値を生み出す労働はネゲントロピー(マイナスのエントロピー)であるから、限界効用逓減の法則は、限界エントロピー逓減の法則と符号が逆なだけで、本質的に同じ法則である。そのことは、じゅうたんから汚れを落とすという逆の操作が、じゅうたんの商品価値を高めることからも明らかである。
話をここまで広げるには、エントロピーの概念を拡張する必要がある。熱エントロピーも物エントロピーも、分子の状態数を複雑性としているが、複雑性を場合の数一般と解釈することにより、エントロピーを、不確定性一般を定量化する概念にすることができる。
一般化されたエントロピーの定義に基づいて、じゅうたんのしみが増えることが、なぜエントロピーの増加なのかを説明しよう。いま、単色のじゅうたんを等面積のいくつかの区域に分割し、ある区域にしみがあるかどうかを当てることにする。しみが全くない場合、確率1で正解を出すことができるので、複雑性は1でエントロピーはゼロである。しみのある区域が一つ増えるにつれて、正解の確率は減り、複雑性、したがってエントロピーは、増加率を逓減させつつ増大する。
4. 付録:数式を用いたエントロピーの説明
以下、数学がわかる人のためにエントロピーが何であるかを数式を用いて説明したい[2]。
エントロピーは、ある物質システムが高温の環境(熱源)に接して受け取った熱量Q(単位ジュール)を、そのシステムの絶対温度T(単位ケルビン)で割った商として定義された。すなわち、エントロピーSの微小増加量は
と表現される。なぜ、Sという記号が使われているのかに関しては、クラウジウスがサディ・カルノー(Sadi Carnot)に敬意を表して、その頭文字を使ったからだというのが有力な説になっている。
システムが受け取る熱量Qに“d”ではなくて“d’”がついているのは、熱量が状態量ではないからである。状態量というのは、喩えるなら、預金残高のようなもので、熱量は個別の入出金に相当する。先月末の預金残高が100万円で、今月末の預金残高が110万円なら、入金10万円でそうなったのか、入金20万円で出金10万円でそうなったのかといった経路の違いに依存することなく、今月の収支が10万円の黒字であることが確定する。状態関数は、経路に依存しないので、物理学では重宝される。以下、熱量を絶対温度で割れば、その関数は、経路に依存しない状態関数となり、積分可能な全微分形になることを示そう。
エネルギー保存則である熱力学第1法則により、システムが受け取った熱というエネルギーは、システムの内部エネルギーUとして貯蓄されるか、システムが、圧力(P)一定のまま体積(V)を増やし、ピストンを動かすなど、仕事を行う形で外部に放出されるかのどちらかの形で保存され、減ったり増えたりしない。すなわち、変化が準静的である場合、理想気体のシステムに関して、以下の数式が成り立つ。
内部エネルギーは、体積の変化とは無関係な温度の関数で、定積熱容量Cvを使って、
と変形することができる。これと、気体の状態方程式 PV=nRT の変形(nは気体分子のモル数、Rは気体定数)、
を数式2に代入すると、
となる。このままでは、全微分が不可能であるが、両辺をTで割ると、微分方程式は全微分形になる。
なぜなら、この右辺のdTとdVの係数に関して、全微分であるための必要十分条件、
が成り立つからだ(ちなみに、どちらもゼロになる)。全微分形にすることができるということは、その積分値であるエントロピーSが、経路に依存しない、つまり、最初と最後の状態だけで変化量を計測できる状態量であるということだ。
これの不定積分を求めると、
となる(Cは不定積分)。
エントロピーが状態量だとするならば、それは具体的に、何の状態の量なのだろうか。話を簡単にするために、外部から熱をもらいながらも、温度変化なしで体積を増加させる準静的過程という具体的な事例で考えてみよう。dT=0より、数式8は、
となる。今、この式を体積V1から体積V2までVで積分すると、
となる。ここで、分子数をm、アボガドロ定数をN、ボルツマン定数をkとすると、n=m/N, R=Nk であるから、これを数式11に代入すると、
となる。ここで、
とおくことで、ボルツマンの公式
を導くことができる。ボルツマンの公式で、Wが何を表しているかを、今考察中の膨張の事例で考えよう。具体的なイメージを持ってもらうために、V2/V1=2、m=100とした以下の模式図でイメージしていただきたい。


最初の気体システムを100個の等体積の部屋に分割すると、分子の配列方法は一つと考えることができる。体積が2倍になる、すなわち部屋の数が2倍になると、各分子が部屋に入る方法はそれぞれ2通りとなるので、分子の配列方法の数は、全体で2の100乗通りになる。
つまり、ボルツマンの公式におけるWとは、気体分子の存在の不確定性を表しており、システム論の用語を使うなら複雑性ということになる。体積を変えずに内部エネルギーを増大させる場合も、気体分子の運動がより活発になり、存在の不確定性が増大するのだから、同じことである。
以上を要するに、熱力学的に定義されたエントロピーの増加量とは、要素配列の可能性の数が増大した割合の対数に定数(ボルツマン定数)をかけた値ということだ。だから、エントロピーは、複雑性=不確定性の対数に比例するということができる。

















ディスカッション
コメント一覧
温度変化のある場合、エントロピーはどう計算しますか?
微小なエントロピーの変化量を温度などの変数で積分します。定積比熱Cが一定の場合、微小なエントロピーの変化量
dS=CdT/T+nRdV/V
を積分すると、
S(T,V)=ClogT+nRlogV+不定積分定数
となります。
ありがとうございます
エントロピーを熱力学第二法則により、常に増大しますが、エネルギーの流入がある系では、外部に捨てることができます。
食べ物を食べて、排せつをすることができれば、エントロピーの増大を抑えられます。
生命現象は非平衡状態の系であり、通常の熱力学の教科書に書いてある平衡状態の熱力学とは異なります。