カロリー制限は何をもたらすのか
「カロリー制限はなぜ寿命を延ばすのか」の参考資料。カロリー制限をした場合とそうでない場合で、自律神経、ホルモン、生理活性物質による反応がどう変わるか、細胞内でのシグナル伝達がどのように行われるか、その結果、栄養素の代謝がどう変わるのかについてまとめた。

栄養素の代謝
私たちは、生命活動の維持に必要なエネルギーを食物中の栄養素から得ている。中でも、糖質、脂質、タンパク質は、三大栄養素である。三大栄養素は、消化吸収後、体の構成成分になることもあるが、エネルギー源にもなる。どちらにせよ、それは代謝のために必要な低エントロピー資源である。
代謝(metabolism)とは、新陳代謝の略で、異化(catabolism)と同化(anabolism)という二つのプロセスからなる。教科書的に定義するなら、以下の図にあるように、異化とは、内呼吸がそうするように、複雑な物質を単純な物質に分解することによってエネルギーを得る過程であり、同化とは、タンパク質、核酸、脂質、糖質の合成がそうするように、エネルギーを使って単純な物質から複雑な物質を合成する過程である。
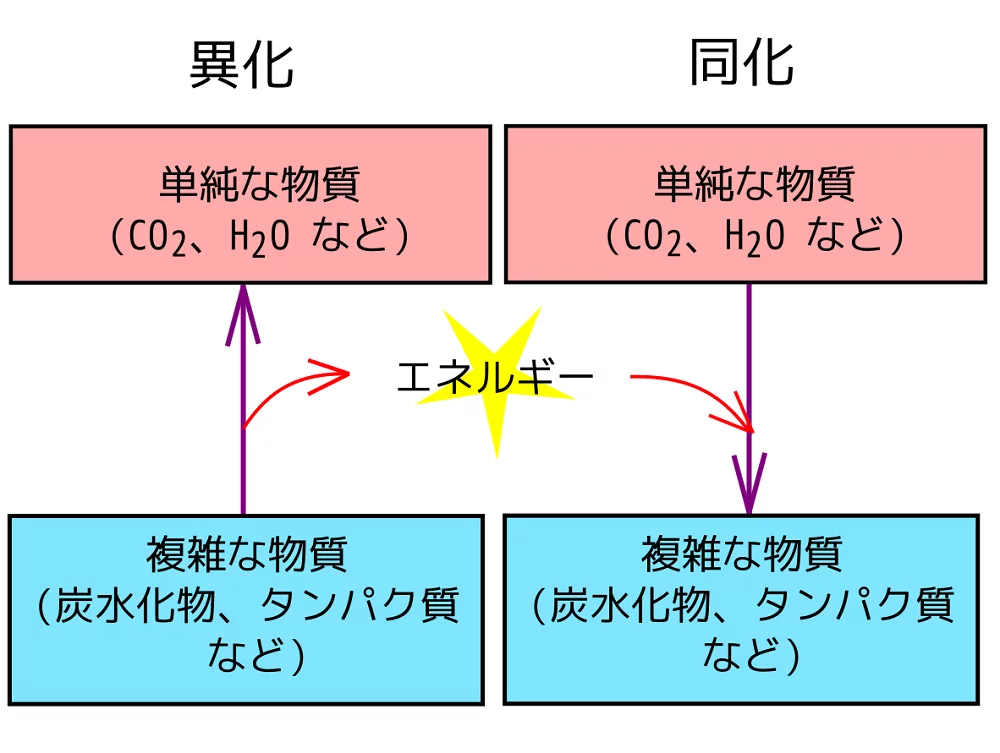
ただし、ここで謂う所の「複雑」という言葉はシステム論的な意味ではなくて、常識的な意味で使っている。システム論的に定義するなら、異化とは、低エントロピーな資源を高エントロピーな廃棄物にすることで、低エントロピーなエネルギー(自由エネルギー)を生み出すことであり、同化とは、低エントロピーなエネルギのエントロピーを高めることで、高エントロピーな廃棄物を低エントロピーな資源に戻す作業である。そして、異化と同化から成る代謝とは、エネルギーを媒介にして、異化(エントロピーの増大)によって同化(エントロピーの縮減)を行うことである。生命システムとしてのヒトは、そのために、低エントロピーな栄養素を摂取し、高エントロピーな廃棄物を熱や排泄物の形で体外に捨てている。
カロリー制限は、エントロピーの増大によるエントロピーの縮減というシステム維持に必要な営みを制限する。それはたんに代謝を制限するという意味においてだけではない。私たちは、有性生殖によって新しい個体を増やすこと(エントロピーの増大)により、寄生者に乗っ取られるリスクの低減(エントロピーの縮減)を行っている。環境の不確定性の増大に対して、自らの不確定性を増大させて対抗するこの方法は、謂わば「毒を以て毒を制す」方法である。その意味での「エントロピーの増大によるエントロピーの縮減というシステム維持に必要な営み」を制限することになるのだ。
栄養が豊富な環境では寄生者も多い。こういう時、生命システムは、豊富な栄養を低エントロピー資源として、個体数を増やし、かつ個体の寿命を短くすることで寄生者に対抗しようとする拡大成長路線を採る。栄養が少ない環境では寄生者も少ない。こういう時、生命システムは、節約保守モードに入り、オートファジーによって細胞を長持ちさせ、さらには個体も長持ちさせ、成長と生殖を抑制するという縮小整理路線を採る。種にとっては、これは変化適応力が低下するという点で必ずしも好ましいことではないが、個体にとっては、寿命が延びるという点では好ましいことである。
「カロリー制限はなぜ寿命を延ばすのか」の結論をシステム論的にまとめると、以上のようになる。本節では、総論はこれぐらいにして、以下、摂取した各栄養素あるいは体内でそれらから既に同化された物質がどのように異化されるかについて、それぞれ見ていくことにしたい。
糖質の代謝
糖質とは、食物繊維以外の炭水化物の栄養素のことである。食物繊維は、小腸では消化されないが、腸内細菌によって分解され、短鎖脂肪酸となり、大腸から吸収される。食物繊維は、食品としては炭水化物に分類されるが、栄養学的には脂質に分類されるので、ここでは糖質のみを扱う。
糖質は、消化の過程で分解され、グルコース、フルクトース、ガラクトースといった単糖類の形で小腸から吸収され、門脈を経て肝臓に送られる。グルコースは、以下の図に示されるとおり、解糖系とクエン酸回路を通じて異化され、エネルギーを生み出す。
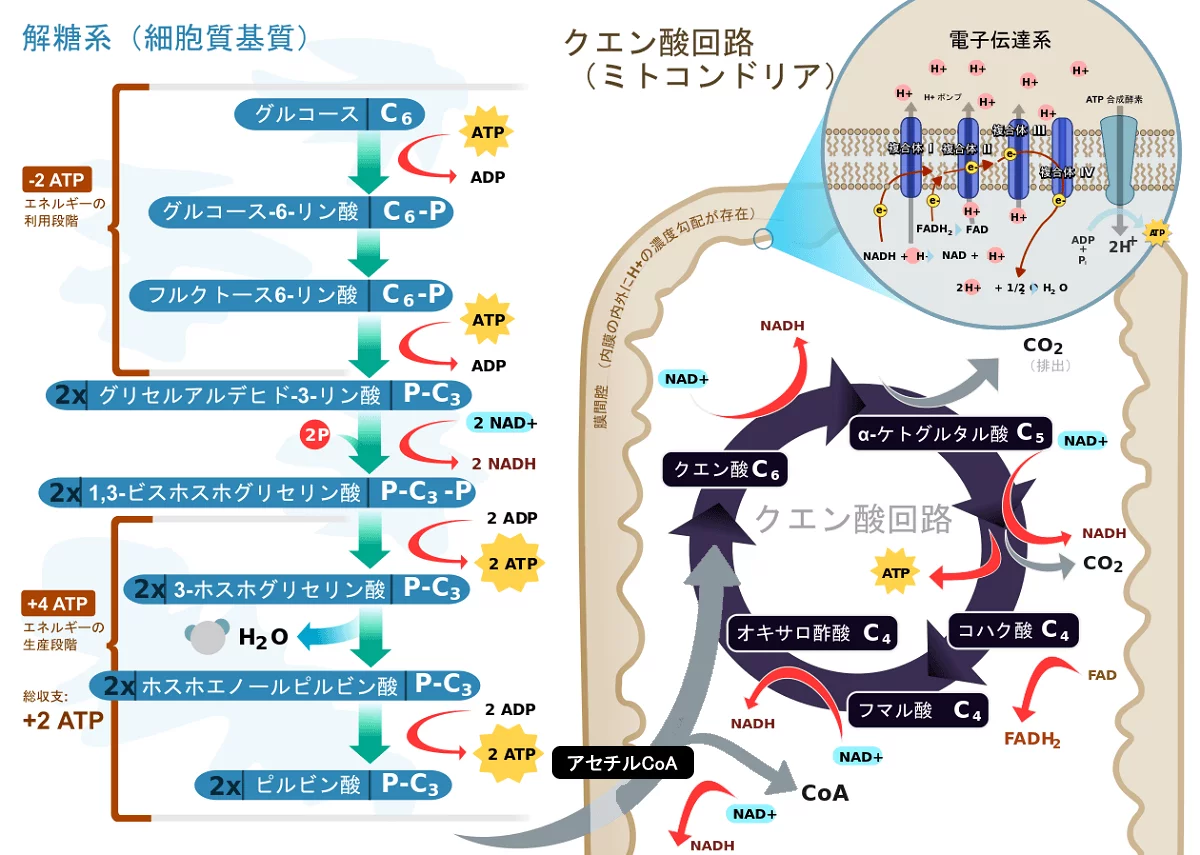
解糖系では、1分子のグルコースから2分子のピルビン酸が生成し、ATP(アデノシン三リン酸)2分子分のエネルギーが生産される。ピルビン酸は、酸素がない時は乳酸として一時的に保存されるが、酸素がある時は、それらはアセチルCoA(アセチル補酵素A/活性酢酸)に変換され、クエン酸回路で異化され、アセチルCoA1分子につきATP15分子分のエネルギーが生産される。不要なグルコースはグリコーゲンに同化される。
フルクトースは、肝臓ではフルクトース-1-リン酸、筋肉ではフルクトース-6-リン酸を経て解糖系に入り、ピルビン酸を生成する。ガラクトースは、ウリジン二リン酸(UDP)ガラクトースを経てグルコース-6-リン酸となり、解糖系に入る。UDP-ガラクトースはグリコーゲン合成にも利用される。結局のところ、糖質は最終的には解糖系とクエン酸回路で異化されるということである。
脂質の代謝
食物に含まれる脂質の90%以上は、中性脂肪(triglyceride トリグリセライド/triacylglycerol トリアシルグリセロール)で、それ以外は、コレステロールやリン脂質などが占める。中性脂肪は、脂肪酸とグリセロール(グリセリン)に分解される。脂肪酸は、β酸化を受けてアセチルCoAとなり、クエン酸回路に入って異化される。グリセロールは、脂質の合成に使われることもあるが、さらにジヒドロキシアセトンリン酸を経て解糖系を逆行する形でグルコースに変換される。これは、グルコースが不足する時に、肝臓と腎臓で起きる代謝で、糖新生(gluconeogenesis)と呼ばれる。
タンパク質の代謝
タンパク質は、消化の過程でアミノ酸に分解され、小腸から吸収される。アミノ酸はエネルギー源として使われることもあるが、体タンパク質の合成材料としても使われる。後者の場合でも、古くなれば分解され、エネルギー源として使われる。それは石油が直接熱源としても使われることもあるが、いったん化学製品の材料として利用された後、サーマル・リサイクルにより熱源としても利用されるのとよく似ている。
アミノ酸がエネルギー源として使われる時は、アミノ基が離脱して、α‐ケト酸(ピルビン酸、アセチルCoA、α-ケトグルタル酸、スクシニルCoA、フマル酸、オキサロ酢酸、アセト酢酸)となり、クエン酸回路に入る。これらは、以下の図に示すとおり、糖新生にも使われる。アセチルCoAとなった後は、ケトン体や脂肪酸の合成に利用されることもある。

カロリー制限時の代謝
以上、見てきたとおり、脂質やタンパク質もエネルギー源となりうるが、第一候補は糖質であり、体内で最初に消費されるエネルギー源は血液中のグルコースである。カロリー制限あるいは糖質制限により、血液中のグルコースが減ると、グリコーゲンが分解され、それでも足りない時は、脂肪とタンパク質が分解され、糖新生によりグルコースが生産される。
糖新生に使われてオキサロ酢酸が肝臓で不足すると、アセチルCoAはクエン酸回路に入ることができなくなる。その場合、以下の図に示されるように、肝臓のミトコンドリアで、アセチルCoAからケトン体(アセト酢酸、D-β-ヒドロキシ酪酸、アセトン)が作られるようになる。ケトン体を作る時は、糖新生が抑制される。
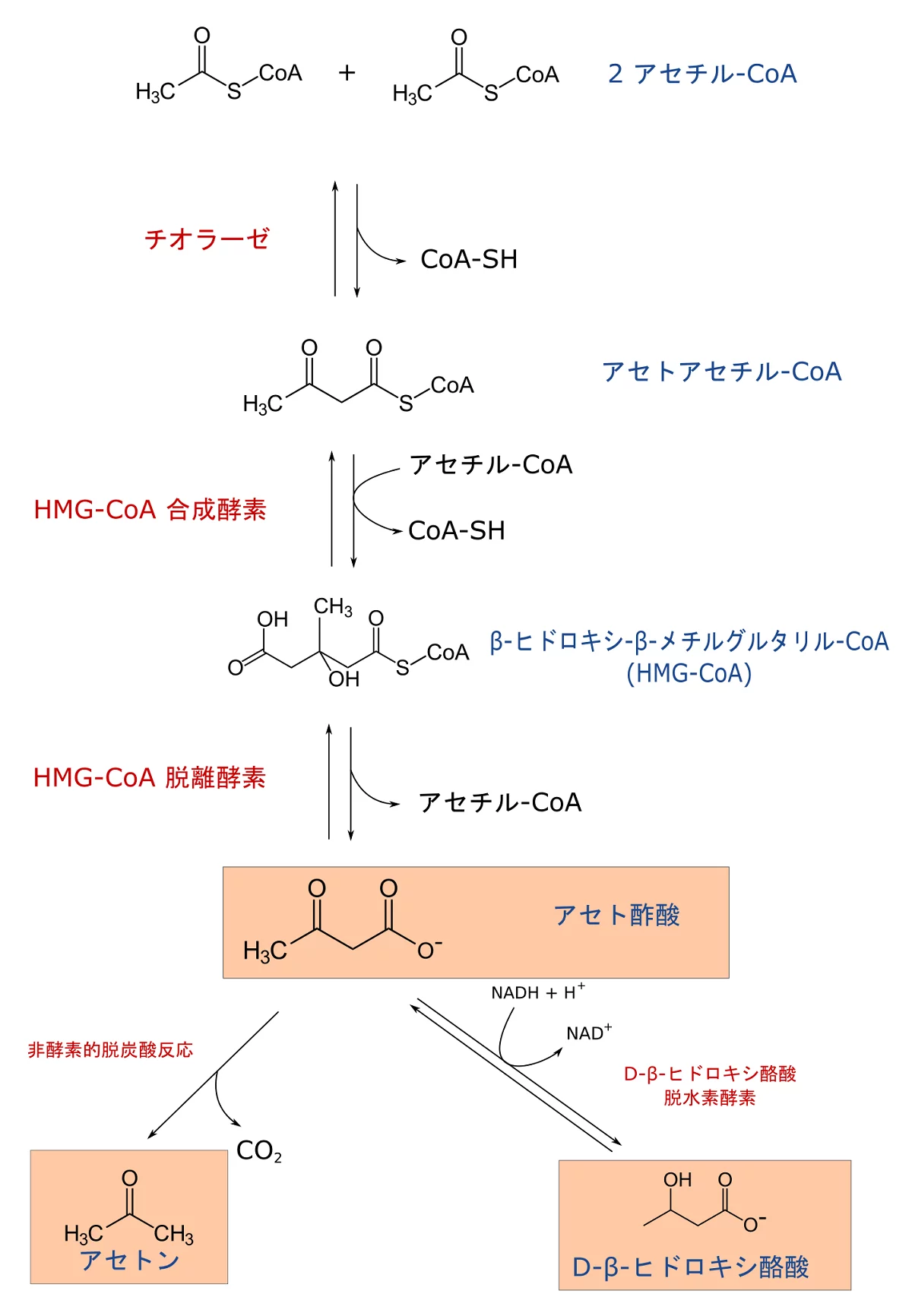
三つのケトン体のうち、アセトンは肺から排出されるが、他の二つは、肝臓以外の組織のミトコンドリアに運ばれ、アセチルCoAに戻されて、エネルギー産出に使われる。脂肪酸は脳関門を通過できないので、脳のエネルギー源にならないのに対して、ケトン体は脳関門を通過できるため、ケトン体は、脳にとってグルコース不足時の代替エネルギー源となる。
このように、私たちの体内では、カロリーを制限してもエネルギー源不足にならないようにする仕組みがある。その調整は、私たちが意識しなくても自動的に自律神経とホルモンによって行われる。このメカニズムを次の節で確認しよう。
自律神経とホルモンによる反応
自律神経システムとは、間脳の視床下部を中枢とする交感神経システムと副交感神経システムとからなる末梢神経システムで、意志とは無関係にストレスに対して体内の各器官を調節する役割を担っている。摂取する栄養の多寡もそうしたストレス要因の一つで、その情報は、交感神経もしくは視床下部に付属する脳下垂体を通じて、各器官に伝達される。

食事によって摂取される炭水化物は、消化されてグルコースなどの単糖類になり、小腸で吸収されて血液に入る。血液中に含まれるグルコースは血糖と呼ばれ、血液中の血糖濃度は血糖値と呼ばれる。カロリー制限をすると、血糖値が下がり、低血糖の血液が視床下部の血糖調節中枢に入る。すると、この中枢から交感神経と脳下垂体を通じて、ストレス対応の指令が出る。逆に血糖値が上がると、副交感神経を通じて膵臓からインスリンが分泌される。
血糖値が上がった時に分泌されるホルモンは一種類しかないのに対して、血糖値が下がった時に分泌されるホルモンには、同じ膵臓から分泌されるグルカゴンに加えて、アドレナリン、糖質コルチコイド、成長ホルモンの四種類がある。これはヒトの歴史の大部分において、生存に危機を与える主なストレスは栄養不足であって、飽食の時代である現代におけるように、血糖値の上昇の方が重大な問題になる時代は稀であったことによる。
もっとも、成長ホルモンは、カロリー制限時には分泌されない。成長ホルモンは、摂取する栄養素は十分足りているが、睡眠や運動などによって一時的に血糖値が下がる時に、細胞の成長や分化を促すために分泌される。カロリー制限によって長期的に飢餓ストレスを与えると、ストレス・ホルモンである糖質コルチコイドが分泌され、糖質コルチコイドは成長ホルモンの分泌を抑制する。だからカロリー制限を続けると、体は大きくはならない。
血糖値とともに栄養状態を示す重要な指標となるのが、脂肪の蓄積である。消費できる以上のエネルギーを摂取すれば、それは脂肪として蓄積されるので、脂肪細胞が大きくなる。反対に、カロリー制限をすると、脂肪細胞が小さくなる。脂肪細胞が大きいか小さいかで異なる生理活性物質が分泌され、代謝のありかたを変える。生理活性物質は、厳密に言えばホルモンではないが、ホルモンのような働きをする。
狭義のホルモンは内分泌腺で作られ、血管やリンパ管に分泌され、標的器官の標的細胞の受容体(レセプター)と結合することで作用する。ホルモンはタンパク質系とステロイド系に大別され、タンパク質系ホルモンが細胞膜外の受容体タンパク質と結合するのに対して、ステロイド系ホルモンは脂溶性が高く、細胞膜を通り抜け、細胞内の受容体と結合する。
いずれにせよ、受容体がホルモンを含めた生理活性物質と結合すると、細胞内の様々な酵素が活性化され、酵素反応が順次増幅する連鎖反応(カスケード)が起き、生理活性物質の情報(シグナル)が細胞内部に伝達され、最終的に核内の転写因子に及び、遺伝子を活性化させて、新しいタンパク質を合成させる、あるいは、遺伝子を不活性化させて、タンパク質の合成を阻害する。
そうした細胞内でのシグナル伝達の詳細は次節に譲ることにして、本節では、カロリー制限をする、あるいはしない時に分泌される重要な生理活性物質について概説する。
インスリンの分泌と作用
インスリン(INS=insulin)は、血糖値が高い時に膵臓のランゲルハンス島B細胞から分泌されるタンパク質系のホルモンで、細胞にグルコースを取り込ませることで、血糖値を低下させる。余ったグルコースはグリコーゲンに合成して肝臓や筋肉に蓄積させ、さらに余るなら、中性脂肪として、脂肪細胞へ取り込ませる。この他、タンパク質、核酸の合成も促進する。ただし、脂肪を過剰に蓄積すると、脂肪細胞は変性を受け、細胞死が生じ、それを免疫システムが攻撃することで、慢性炎症が発生する。カロリー制限が、慢性炎症を防ぐのは、脂肪の蓄積を阻止することによってであると説明できる。
グルカゴンの分泌と作用
グルカゴン (glucagon) は、血糖値が低い時に膵臓のランゲルハンス島A細胞から分泌されるタンパク質系のホルモンで、インスリンとは逆に、肝臓や筋肉に蓄えられたグリコーゲンをグルコースへ分解し、血糖値を上昇させる。また肝臓で、アミノ酸、乳酸などをグルコースに変える糖新生をも促進する。
アドレナリンの分泌と作用
アドレナリン(adrenaline)、別名エピネフリン(epinephrine)は、血糖値が低い時に副腎髄質より分泌されるタンパク質系のホルモンで、肝臓や筋肉に蓄積されたグリコーゲンを分解したり、糖新生を促したりすることを通じてグルコースを生産し、血糖値を上昇させる。また、脂肪が過剰に蓄積すると、脂肪細胞は、レプチンというホルモンを分泌して、飽食シグナルを伝達し、アドレナリンとノルアドレナリンを増加させ、交感神経の活動を亢進させ、脂肪分解を促進し、そのエネルギーを利用しやすくするというネガティブ・フィードバックが働く。
アドレナリンは、脳に作用するノルアドレナリンとともに、ストレス・ホルモンの主力であり、低血糖、過剰脂肪以外にも、様々なストレスで交感神経が興奮した時に分泌される。典型的なケースは戦う場合であり、身体システムを経済システムに譬えると、戦争によるリフレ効果に似た消費刺激効果を人体に与える。
糖質コルチコイドの分泌と作用
糖質コルチコイド(glucocorticoid グルココルチコイド)は、血糖値が低い時に副腎皮質から分泌されるステロイド系ホルモンで、タンパク質のアミノ酸への分解を促進すると同時に、糖新生を促進することで血糖値を上昇させる。糖質コルチコイドには、コルチゾール、コルチコステロン、コルチゾンの三種類があるが、ヒトの場合その作用の95%をコルチゾールが担っている。カロリーを制限すると血清コルチゾール濃度が、通常食摂取者だけでなく、マラソンランナーと比べても、高くなることがわかっている[6]。コルチゾールは、ストレス・ホルモンであり、免疫機能の低下や不妊をもたらす。これはカロリー制限の実験結果と合致する。
成長ホルモンの分泌と作用
成長ホルモン(growth hormone)は、睡眠や運動などによって血糖値が低くなった時に脳下垂体前葉から分泌されるタンパク質系のホルモンで、肝臓でのグリコーゲン分解を促進し、インスリンの働きを抑制することで、血糖値を上昇させる。また、空腹時に胃から分泌されるグレリンは、視床下部に働きかけて食欲を増進させつつ、下垂体に成長ホルモンを分泌させる。成長ホルモンは、脂肪細胞の中の中性脂肪を脂肪酸とグリセロールに分解し、エネルギーとして消費しやすくする。また、肝臓に働きかけて、IGF-1(Insulin-like Growth Factor インスリン様増殖因子1)を分泌させ、細胞の成長と分化を促す。ただし、アミノ酸が不足しているときには、タンパク質の合成ができないので、肝臓細胞がインスリン様増殖因子結合タンパク質-1(IGFBP-1)遺伝子の転写を増加させ、IGF-1を抑制する[7]。
アディポサイトカインの分泌と作用
アディポサイトカイン(Adipo-cytokine)とは、脂肪細胞から分泌される生理活性物質である。「アディポ」は「脂肪」、「サイト」は「細胞」、「カイン」は「動き」という意味のギリシャ語に由来する。そして「サイトカイン」は、「細胞にシグナル伝達するタンパク質」という意味で使われる。サイトカインは、狭義のホルモンではないが、ホルモンのような役割を果たす。
カロリー制限の際、脂肪の蓄積が小さい時に脂肪細胞から分泌される生理活性物質は、アディポネクチン(adiponectin)で、脂肪の分解、インスリン感受性の亢進、グルコースの細胞への取り込みを促す。脂肪細胞がやや大きくなると、レプチン(leptin)が分泌され、以下の促進によって肥満を抑制しようとする。これらは、生活習慣病を予防するがゆえに、善玉アディポサイトカインと呼ばれる。
カロリー制限をせずに、脂肪細胞を大きくさせてしまうと、善玉アディポサイトカインの分泌が低下し、代わりにTNF(Tumor Necrosis Factor 腫瘍壊死因子)-α、IL(InterLeukin インターロイキン)-6、MCP(Monocyte Chemotactic Protein 単球走化性タンパク質)-1、Angptl(Angiopoietin-like protein アンジオポエチン様タンパク質)-2、PAI(Plasminogen Activator Inhibitor プラスミノーゲン活性化抑制因子)-1、HB-EGF(Heparin-Binding EGF-like growth factor ヘパリン結合性上皮細胞成長因子)といった悪玉アディポサイトカインが肥大した脂肪細胞から分泌される。これらは、高脂血症、動脈硬化、高血圧、糖尿病、心筋梗塞、脳卒中といった生活習慣病の症状を悪化させる。
細胞内でのシグナル伝達による反応
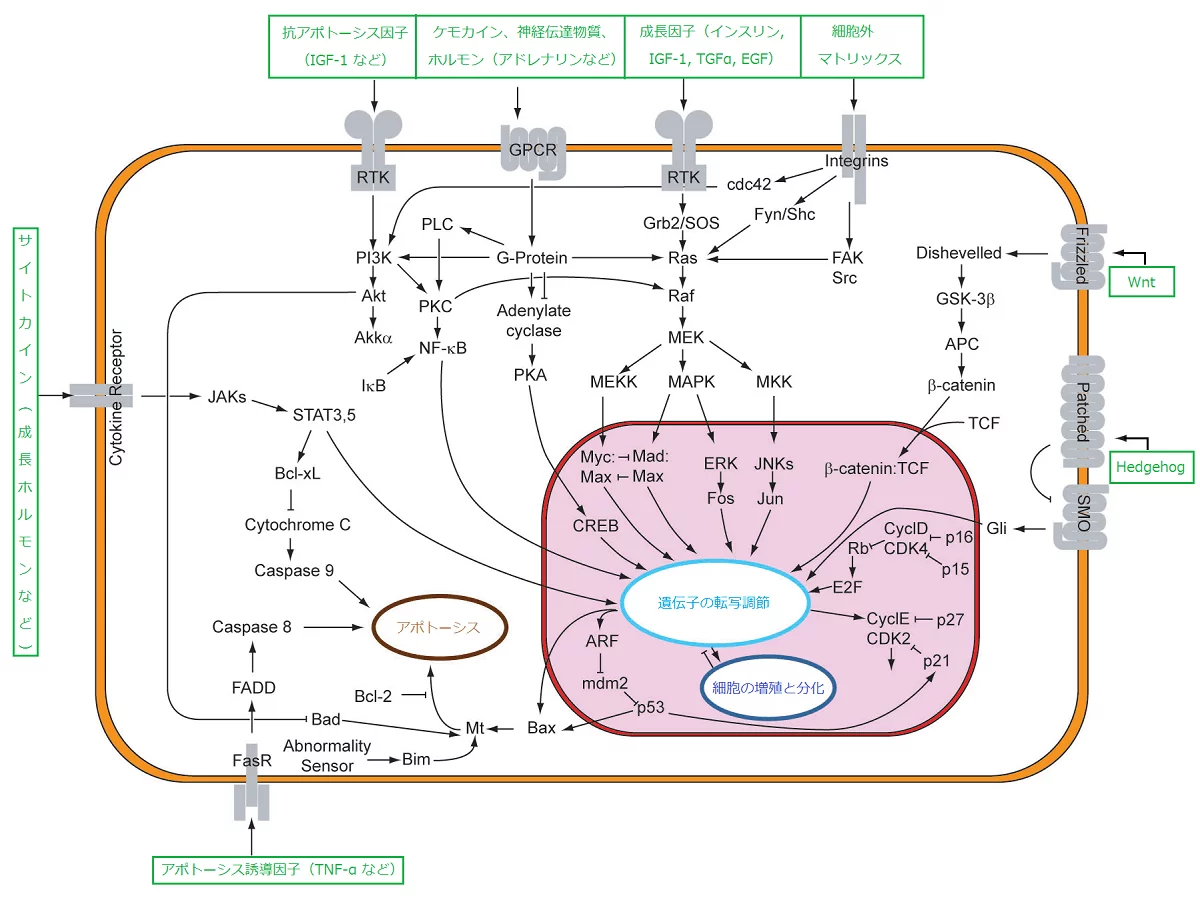
脳を司令塔とする身体システムは、摂取栄養素の多寡に応じて異なった指令を各臓器と各細胞に出し、転写因子を通じて核内の遺伝子の発現を制御する。それは国家の命令が、各自治体や各企業に出され、最終的には個人を動かすようなものだ。本節では、ホルモンが細胞内の転写因子にどのようなシグナル伝達を行い、その結果どうなるかについて解説する。
インスリンによるシグナル伝達
齧歯類にカロリー制限を施すと、インスリンと分泌が抑制され、IGF-1が阻害される。IGFは、「インスリン様増殖因子」という名が示すとおり、インスリンと配列がよく似ており、インスリンのような働きをする成長因子である。IGF-2が生命発生時に機能する成長因子であるに対して、IGF-1はその後の成長因子となる。
飽食時には、インスリン(INS)とIGF-1が増え、その受容体を通じて、
INS/IGF-1→Grb2/SOS→Ras→Raf→MEK→MAPK→ERK→細胞の増殖と分化
というカスケードを開始し、増殖因子による刺激を核に伝え、細胞の増殖と分化を促す[8]。細胞の増殖と分化のためには、細胞の材料であるタンパク質と脂質、そしてエネルギーを生産するための解糖が必要である。そこで、
INS/IGF-1→IRS→PI3K→PIP3→PDK→Akt¬TSC¬Rheb→mTORC1→タンパク質と脂質の合成
というカスケードにより、mTORC1を活性化し[9]、タンパク質と脂質の合成を促す。
但し、齧歯類と異なり、ヒトでは、カロリー制限しても、タンパク質の摂取が十分なら、血清IGF-1濃度およびIGF-1:IGFBP-3比が低下しない。他方で、タンパク質の摂取を制限すると、血清IGF-1濃度を低下させる[10]。GH(成長ホルモン)活性の低下がマウスの寿命延長に強力に作用することから、GHの作用を薬学的に阻害することで老化を遅らせられるのではないかという仮説が生まれた。さらに、GH/IGF-1軸の活性が低下したマウスやヒトは、加齢に関連する2つの主要な病気である癌や糖尿病から保護されることもわかっている[11]。
INS/IGF-1のシグナル伝達は、タンパク質と脂質の合成を促す一方で、アポトーシス(apoptosis プログラムされた細胞死)をも促す。この二つの作用は、矛盾しているようにも見えるが、成長する時には、機能不全に陥った細胞を自殺に追い込むと同時に、新しく細胞を作らなければならないので、細胞単位の新陳代謝という意味で整合的である。ただし、エネルギーは足りているので、オートファジーは抑制される。
この経路の途中でAkt(PKB プロテインキナーゼB)が活性化されることにより、解糖が促される。
INS/IGF-1→IRS→PI3K→PIP3→PDK→Akt→PFKFB2→解糖
Aktは、Bad, Baxを阻害することで、アポトーシスを抑制する[12]。これはmTORC1の作用と矛盾するように見えるが、実は、mTORC1も常にアポトーシスを促進しているわけではない[13]。
カロリー制限は、一方では、アポトーシス促進転写因子であるBaxをミトコンドリアから隔離して、細胞死が起きないようにし[14]、他方では、FOXO(Forkhead box O フォークヘッド転写因子O)を通じてBimなどを発現させ、悪性腫瘍のアポトーシスを誘導する[15]。
つまり、カロリー制限をする場合でも、しない場合でも、アポトーシスを抑制するシグナル伝達と促進するシグナル伝達が併存するのであるが、その意味合いは少し異なる。カロリー制限はオートファジーを通じて細胞内新陳代謝を促進し、細胞の機能不全を防ぐ。だからアポトーシスを行う必要があまりなくなるのだが、オートファジーでは十分でない時はアポトーシスを行わざるを得ない。これに対して、カロリー制限をしない時は、成長が優先されるので、アポトーシスによる細胞死をできれば回避したいが、悪性腫瘍の発生と成長を抑制するには、アポトーシスが必要になる。だから、どちらの場合でも、アポトーシスを抑制するシグナル伝達と促進するシグナル伝達が併存すると考えられる。
グルカゴンによるシグナル伝達
カロリー制限時に分泌されるホルモン、グルカゴンは、環状アデノシン一リン酸(cyclic AMP=cAMP)をメッセンジャーとして、クラスⅡヒストン脱アセチル化酵素(Class Ⅱa HDAC)を脱リン化する。脱リン化されたクラスⅡヒストン脱アセチル化酵素は、核に移行し、FoxO(Forkhead Box O フォークヘッド転写因子O)を脱アセチル化し、活性化することによって、糖新生酵素(G6Pase/PEPCK)の転写を活性化する[17]。
グルカゴン→cAMP→Class Ⅱa HDAC→FoxO→G6Pase/PEPCK→糖新生
グルカゴンは、また、cAMPを介して、タンパク質活性化酵素であるプロテインキナーゼA(PKA=Protein Kinase A)を核内へ移行させる。すると、核内でCREB(cAMP-responsive element-binding protein)が活性化し、CRTC(cAMP-regulated transcriptional co-activators)やCBP(CREB-binding protein)/p300と結合して、CREB標的遺伝子である糖新生酵素(G6Pase/PEPCK)の転写を活性化する[18]。
グルカゴン→cAMP→PKA→CREB→CBP→糖新生
PKAは、Badを阻害することで、アポトーシスを抑制する。カロリー制限時にPKAがSIK2(Salt-Inducible Kinase 2)を阻害するのに対して、飽食時にはAktがSIK2を活性化し、それがCRTC、CBP/p300とCREBとの結合を阻害するため、糖新生が抑制される。なお、カロリー制限によりケトン体が作られる時も、CRTCが核から除外されることで糖新生が抑制される。
アドレナリンによるシグナル伝達
アドレナリンは、Gsαサブユニットと共役するβ-アドレナリン受容体(β-AR=Adrenergic Receptor)を介して、ATPをAC(アデニル酸シクラーゼ Adenylate Cyclase)触媒のもとcAMPとピロリン酸に変換するシグナルを伝達する。cAMPによってタンパク質キナーゼ(PKA)が活性化され、そこから先は、グルカゴンによるシグナル伝達の時と同様の経路で、糖新生を促進し、アポトーシスを抑制する。
アドレナリン→β-AR→Gsα→AC→cAMP→PKA→CREB→CBP→糖新生
糖質コルチコイドによるシグナル伝達
糖質コルチコイドは、細胞内でGCR(GlucoCorticoid Receptor 糖質コルチコイドレセプター)と結合し、IκBα(NF-κB inhibitor α NF-κB阻害剤アルファ)タンパク質合成の誘導を介して、NF-κB(Nuclear Factor-κB 核内因子カッパービー)の核内移行を阻止する。NF-κBは、核内に移行すると、TNF-α(Tumor Necrosis Factor-α 腫瘍壊死因子アルファ)の転写を活性化するのだが、糖質コルチコイドはそれを阻止するのである[19]。
糖質コルチコイド→GCRα→IκBα¬NF-κB→TNF-α→炎症、アポトーシス
TNF-αは肥満時に増殖する炎症性サイトカイン(免疫システムの細胞から分泌され、炎症をもたらすタンパク質)であり、感染防御やアポトーシスによる抗腫瘍作用がある一方、炎症や動脈硬化などをもたらす。カロリー制限は、糖質コルチコイドによるシグナル伝達を通じて抗炎症作用や生活習慣病防止をもたらしてくれる反面で、免疫機能の低下をもたらすのは、このためである。
成長ホルモンによるシグナル伝達
成長ホルモンは、GHR(Growth Hormone Receptor 成長ホルモン受容体)を介して、タンパク質リン酸化酵素、JAK2(Janus kinase 2)を活性化させ、STAT(Signal Transducers and Activator of Transcription シグナル伝達兼転写活性化因子)という転写因子に変換されるタンパク質をリン酸化するシグナルを伝達する[20]。リン酸化されたSTATは細胞核に侵入し、細胞の成長や分化を促す一方で、その免疫機能ゆえに炎症を惹き起こす。
成長ホルモン→GHR→JAK2→STAT→細胞の増殖と分化、免疫機能の強化
成長ホルモンは、IGF-1を分泌することで、
成長ホルモン→IGF-1→IRS→PI3K→PIP3→PDK→Akt¬TSC¬Rheb→mTORC1
というカスケードを開始する。すなわち、カロリー制限を行わなければ、成長ホルモンやIGF-1の分泌が増え、成長優先のためアポトーシスが抑制され、悪性腫瘍が発生しやすくなる[21]。
カロリー制限時には、糖質コルチコイドが、脳下垂体前葉に対しては成長ホルモンの分泌を、肝臓に対してはIGF-1の発現を抑制することで、このカスケードを阻害し、mTORC1の働きを抑制する。発展拡大から整理縮小へと路線が変更されるのだ。アポトーシスが抑制されるという点では同じなのだが、オートファジーにより細胞の癌化が阻止される。
アディポサイトカインによるシグナル伝達
カロリー制限時に分泌されるアディポサイトカインであるアディポネクチンは、骨格筋においてAdipoR1(Adiponectin receptor 1 アディポネクチン受容体1)に結合し、細胞外Ca2+流入を誘導することで、CAMKK(Calcium/calmodulin-dependent protein kinase kinase カルシウムカルモジュリン依存性タンパク質キナーゼキナーゼ)を活性化し、AMPK(AMP-activated protein kinase AMP活性化プロテインキナーゼ)の発現を増加させる[22]。
アディポネクチン→AdipoR1→Ca2+→CAMKK→AMPK
AMPKは、代謝エネルギーの低下に伴って電子伝達系で変動するNAD+/NADH比とAMP/ATP比によっても発現が増加する。NADとは、脱水素酵素の補酵素、ニコチンアミドアデニンジヌクレオチド(Nicotinamide Adenine Dinucleotide)のことで、酸化剤の NAD+と還元剤のNADHの二つがあり、電子伝達系で酸化還元酵素として機能する。

電子伝達系は「好気呼吸における解糖系とクエン酸回路」の図にも描かれているが、ここでは話を分かりやすくするために、複雑な電子伝達系を簡略化して、以下の図にまとめてみた。
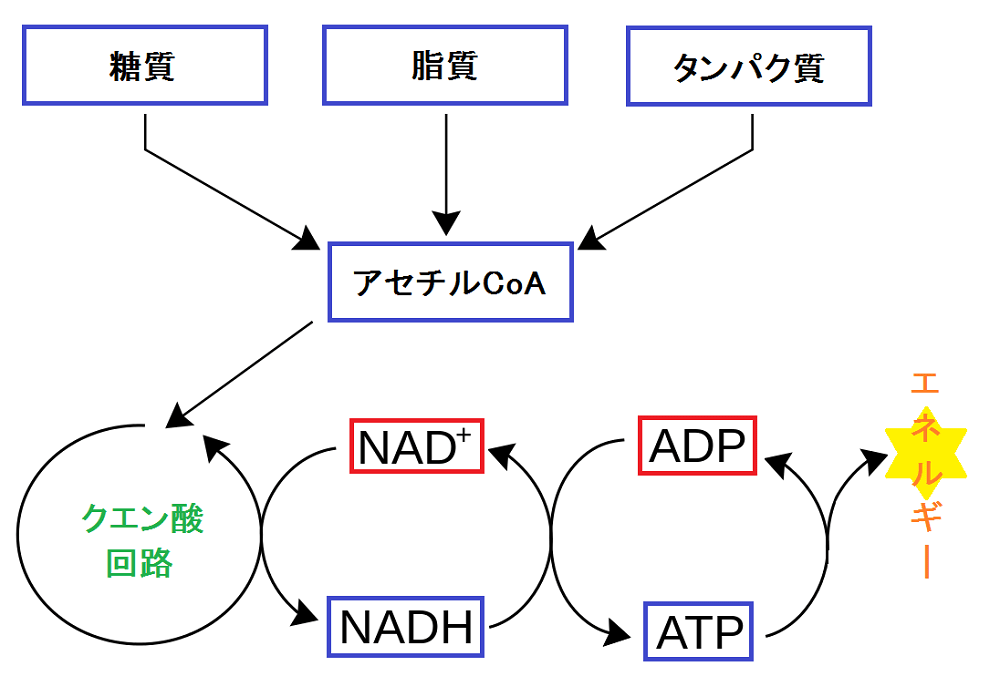
糖質であれ、脂質であれ、タンパク質であれ、アセチルCoAに変換された後、クエン酸回路に入り、NAD+をNADHに還元する。この時、「ニコチンアミドアデニンジヌクレオチドの酸化還元反応」の図で説明するなら、左から右に反応が進むので、プロトン(水素イオン)が減る。その結果、ミトコンドリア内膜の内外にH+の濃度勾配が存在する、つまり電位差が生じることになる。異化で低エントロピー資源のエントロピーを増大させることで生じた自由エネルギーで、プロトンの分散エントロピーを縮減したと解釈できるが、こうした説明よりも、異化で生じたエネルギーがミトコンドリア蓄電池に充電されたという説明の方が分かりやすいだろう。
この蓄電池は、NADHがNAD+に戻ることで、放電する。
NADH + H+ + ½O2 → NAD+ + 2H2O
この時、ATP合成酵素が、プロトン濃度勾配と膜電位からなるプロトン駆動力を用いて、ADPとリン酸からATPを合成し、プロトン濃度勾配と膜電位が解消される。
ADP + Pi → ATP + H2O
この反応式が右から左に移行する時に生まれる自由エネルギーは、生命維持のために汎用的に使われるがゆえに、ATP、すなわち、ADPとリンとの結合エネルギーは「エネルギーの通貨」と呼ばれる。経済学者はしばしば通貨の流通を血液の循環に譬えるが、血管や血液は交通インフラの機能を果たしているだけなので、これは不適切である。
飽食時には、「栄養素の異化」の図で青色の線で囲んだ栄養素が増え、NAD+に対するNADH、ADPに対するATPが相対的に増える[25]。つまり赤色の線で囲んだNAD+とADPが相対的に減る。ATPが増えすぎて、NAD+が少なくなると、クエン酸回路の代謝が抑制される。ATPを「エネルギーの通貨」とみなす比喩に乗っかって譬えると、ATPが増えすぎるということは、通貨供給量が多すぎる、つまりインフレであるということなので、政府は緊縮財政、中央銀行は金融引き締めによってディスインフレーションに努めなければならない。私たちの体も、栄養素の消費を抑制しようとする。
反対に、摂取カロリーを制限すると、青色の線で囲んだ栄養素が減り、NAD+からNADH、ADPからATPへの変換が滞り、その結果、NAD+に対するNADH、ADPに対するATPが相対的に少なくなり、赤色の線で囲んだNAD+とADPが相対的に増える。ATPが供給不足になるということは、経済システムで言うと、デフレに相当する。個人が消費を手控え、企業が投資に消極的になって、内部留保を貯め込み、銀行が貸し渋り、貨幣の流通速度が低下してデフレになると、貨幣の流通速度を高めるために、政府は財政を出動し、中央銀行は金融を緩和する。身体システムにおいても、クエン酸回路の回転速度や電子伝達系で伝達速度が低下して、エネルギー供給が不足すると、体に溜め込んだ栄養素の内部留保を吐き出し、栄養素の消費を活性化するように指令を出すのである。
カロリー制限は寿命延長効果を持つが、これはどう解釈したらよいだろうか。デフレ経済下では、競争力のない企業が淘汰されるが、リフレ局面では、それで失業した労働者たちが生き残った優良企業によって再雇用されるため、労働生産性が向上し、一国の経済はより健全になる。もとより、日本のように、政府が終身雇用を守るため規制と補助金で衰退産業を保護し、労働生産性を低いまま放置している国は、いつまでたってもデフレから脱却できない。
幸いなことに、私たちの身体システムは、日本政府ほど愚かではなくて、飢餓状態というデフレ状況下では、機能不全に陥ったタンパク質をオートファジーによって消滅させると同時に、その代謝で生まれるエネルギーを飢餓解消のために役立てる。その結果、身体システムは健全な状態に保たれる。もとより、カロリー制限を続けることは、鎖国をしながらリフレーションするようなものであるから、経済は健全性を維持するけれども、規模は拡大せず、黒船来航に対して無防備である。すなわち、外部の侵略者に対する免疫機能は低下するということである。
細胞内シグナル伝達に話を進めよう。飢餓状態では、NAD+に対するNADH、ADPに対するATPが相対的に少なくなることは既に述べたが、ATPが不足すると、さらに、リン酸結合を二つ持ったADPから一つしかないAMPと三つあるATPが作られるという反応が起きる。
2ADP→ATP+AMP
それゆえ、飢餓状態では、AMPも増える。AMPはもともと少ないので、ADP/ATP比よりもAMP/ATP比の方が顕著に変動する。それゆえ、前者だけではなく、後者も飢餓のシグナルとして使われる。
NAD+/NADH比の増大で活性化するのがSirt1(哺乳類のサーチュイン遺伝子)であるのに対して、AMP/ATP比の増大で活性化するのは、AMPKである。ただし、AMPKが活性化すると、NAD+/NADH比も増大する[26]という効果があるので、AMPKから話を始めよう。
AMPKは、「エネルギー恒常性を維持する栄養素とエネルギーの感知器[27]」で、ちょうど中央銀行が絶えずマネーサプライの伸び率をモニターし、これを調節しようとするように、AMPKも絶えずADP/ATP比やAMP/ATP比をモニターし、これを調節しようとする。
AMPKの活性化とNAD+/NADH比の増大は、サーチュイン(Sirt1)遺伝子を発現する。Sirt1は、酵母の長寿遺伝子 Sir2(Silent mating-type Information Regulation 2)[28]の哺乳類におけるホモログ(相同性のある遺伝子)で、NAD+依存性のヒストン脱アセチル化酵素であることがわかっている[29]。Sirt1は、FoxOやPGC-1αといった核内転写因子を発現する。
AMPK→NAD+→Sirt1→PGC-1α, FoxO
阻害する転写因子は以下のとおり。
AMPK→NAD+→Sirt1¬Bax, p53, PPAR-γ, NF-κB
PGC-1α(PPAR-γ coactivator-1α ピーピーエイアールガンマ活性化補助因子-1アルファ)は、ミトコンドリアを構成する分子で、その名のとおり、PPAR-γ(Peroxisome Proliferator-Activated Receptor γ ペルオキシソーム増殖剤活性化受容体ガンマ)を活性化する補助因子である[30]。Sirt1の発現は、PGC-1αを通じて、ミトコンドリアにおける糖代謝や脂質代謝を改善する。カロリー制限以外でも、寒冷地対応[31]やエネルギーを消費する運動[32]が、PGC-1αを発現することが知られている。
FoxOは、ストレスへの抵抗を高め、細胞周期を抑制し、糖新生を促す。また、アポトーシスを誘導し、血管新生を阻害することで悪性腫瘍の増殖や転移を抑制する。ただし、Sirt1は、Baxやp53といったアポトーシス促進転写因子を阻害するので、カロリー制限でアポトーシスが活発になるということはない。また発癌防止という点でも両義的な役割を果たす[33]。カロリー制限の寿命延長効果という点で最も重要なFoxOの働きは、ATG遺伝子の発現によるオートファジーの促進である[34]。オートファジーが行う細胞のハウス・キーピングは、細胞を若返らせ、老化によって起きる疾患の原因を取り除く。
血糖値が低下すると、糖質コルチコイドがNF-κBの核内移行を阻止し、TNF-αの転写を阻止することは既に述べた。Sirt1も同じ働きで炎症が起きることを防ぐ。これに対して、カロリー制限をせずに脂肪を蓄積すると、TNF-αなどの悪玉アディポサイトカインが炎症を惹き起こす。それゆえ、カロリー制限は、悪玉アディポサイトカインが原因となって起きる生活習慣病を防ぐことで、寿命を延長すると言える。
参照情報
- ジェームズ・W・クレメント『スイッチ―オートファジーで手に入れる究極の健康長寿』日経BP (2021/1/8).
- デビッド・A・シンクレア『ライフスパン―老いなき世界』東洋経済新報社 (2020/9/16).
- 小林 武彦『寿命はなぜ決まっているのか 長生き遺伝子のヒミツ』岩波書店 (2016/2/19).
- 森望『寿命遺伝子 なぜ老いるのか 何が長寿を導くのか』講談社 (2021/3/18).
- 山田悟『カロリー制限の大罪』幻冬舎 (2017/6/21).
- 山本 雅, 仙波 憲太郎, 山梨 裕司『イラストで徹底理解する シグナル伝達キーワード事典』羊土社 (2012/8/7).
- ↑すじにくシチュー. “異化と同化.” Licensed under CC-0 and modified by me.
- ↑Fvasconcellos, RegisFrey, ふわふわ. “好気呼吸の概略の説明図 Figure for description of aerobic respiration.” Licensed under CC-BY-SA and modified by me.
- ↑Mikael Häggström. “Amino acid catabolism revised.” Licensed under CC-0 and modified by me.
- ↑Sav vas. “Ketogenesis pathway.” Licensed under CC-0 and modified by me.
- ↑ライフサイエンス統合データベースプロジェクト. “脳下垂体.” Licensed under CC-BY-SA. Anatomography maintained by Life Science Databases.
- ↑Yang, Ling, et al. “Long-Term Calorie Restriction Enhances Cellular Quality-Control Processes in Human Skeletal Muscle." Cell reports 14.3 (2016): 422-428.
- ↑Fontana, Luigi, Dennis T. Villareal, Sai K. Das, Steven R. Smith, Simin N. Meydani, Anastassios G. Pittas, Samuel Klein, et al. “Effects of 2-Year Calorie Restriction on Circulating Levels of IGF-1, IGF-Binding Proteins and Cortisol in Nonobese Men and Women: A Randomized Clinical Trial.” Aging Cell 15, no. 1 (2016): 22–27.
- ↑Bevan, Paul. “Insulin signalling." Journal of cell science 114.8 (2001): 1429-1430.
- ↑Huang, Jingxiang, and Brendan D. Manning. “A complex interplay between Akt, TSC2 and the two mTOR complexes." (2009): 217-222. シグナル伝達において、“→”は活性化、“¬” は阻害を意味するものとする。“¬TSC¬Rheb”というように、阻害が二つ重なるがゆえに、インスリンとIGF-1は、最終的には、mTORC1を活性化することになる。
- ↑Fontana, Luigi, Edward P. Weiss, Dennis T. Villareal, Samuel Klein, and John O. Holloszy. “Long-Term Effects of Calorie or Protein Restriction on Serum IGF-1 and IGFBP-3 Concentration in Humans.” Aging Cell 7, no. 5 (2008): 681–87.
- ↑Junnila, Riia K., Edward O. List, Darlene E. Berryman, John W. Murrey, and John J. Kopchick. “The GH/IGF-1 Axis in Ageing and Longevity.” Nature Reviews Endocrinology 9, no. 6 (June 2013): 366–76.
- ↑Yamaguchi, Hirohito, and Wang Hong-Gang. “The protein kinase PKB/Akt regulates cell survival and apoptosis by inhibiting Bax conformational change." Oncogene 20.53 (2001): 7779.
- ↑Castedo, M., K. F. Ferri, and G. Kroemer. “Mammalian Target of Rapamycin (mTOR): Pro- and Anti-Apoptotic." Cell death and differentiation 9, no. 2 (2002): 99-100.
- ↑Cohen, Haim Y., Christine Miller, Kevin J. Bitterman, Nathan R. Wall, Brian Hekking, Benedikt Kessler, Konrad T. Howitz, Myriam Gorospe, Rafael de Cabo, and David A. Sinclair. “Calorie Restriction Promotes Mammalian Cell Survival by Inducing the SIRT1 Deacetylase." Science 305, no. 5682 (2004): 390-392.
- ↑Fu, Z., and Donald J. Tindall. “FOXOs, cancer and regulation of apoptosis." Oncogene 27.16 (2008): 2312-2319.
- ↑cybertory. “Signal transduction pathways.” Licensed under CC-0 and modified by me.
- ↑Mihaylova, Maria M., Debbie S. Vasquez, Kim Ravnskjaer, Pierre-Damien Denechaud, Ruth T. Yu, Jacqueline G. Alvarez, Michael Downes, Ronald M. Evans, Marc Montminy, and Reuben J. Shaw. “Class IIa Histone Deacetylases Are Hormone-Activated Regulators of FOXO and Mammalian Glucose Homeostasis.” Cell 145, no. 4 (May 13, 2011): 607–21. https://doi.org/10.1016/j.cell.2011.03.043.
- ↑Altarejos, Judith Y., and Marc Montminy. “CREB and the CRTC co-activators: sensors for hormonal and metabolic signals." Nature reviews Molecular cell biology 12, no. 3 (2011): 141-151.
- ↑Fan, W., et al. “Glucocorticoids selectively inhibit taxol-induced apoptosis in a human breast cancer cell line." CELLULAR PHARMACOLOGY 3 (1996): 435-440.
- ↑Brooks, Andrew J., Wei Dai, Megan L. O’Mara, Daniel Abankwa, Yash Chhabra, Rebecca A. Pelekanos, Olivier Gardon et al. “Mechanism of Activation of Protein Kinase JAK2 by the Growth Hormone Receptor." Science 344, no. 6185 (2014): 1249783.
- ↑Yakar, Shoshana, Derek LeRoith, and Pnina Brodt. “The role of the growth hormone/insulin-like growth factor axis in tumor growth and progression: Lessons from animal models." Cytokine & growth factor reviews 16, no. 4 (2005): 407-420.
- ↑Iwabu, Masato, Toshimasa Yamauchi, Miki Okada-Iwabu, Koji Sato, Tatsuro Nakagawa, Masaaki Funata, Mamiko Yamaguchi et al. “Adiponectin and AdipoR1 regulate PGC-1|[agr| and mitochondria by Ca2+ and AMPK/SIRT1]." Nature 464, no. 7293 (2010): 1313-1319.
- ↑Fvasconcellos. “Reduction and oxidation of the coenzyme NAD.” Licensed under CC-0 and modified by me.
- ↑Tim Vickers. “Simplified diagram of catabolism of proteins, carbohydrates and fats.” Licensed under CC-0 and modified by me.
- ↑Akhlaq A. Farooqui. High Calorie Diet and the Human Brain: Metabolic Consequences of Long-Term Consumption. Springer; 2015版 (2015/3/25). p.85.
- ↑Cantó, Carles, Zachary Gerhart-Hines, Jerome N. Feige, Marie Lagouge, Lilia Noriega, Jill C. Milne, Peter J. Elliott, Pere Puigserver, and Johan Auwerx. “AMPK regulates energy expenditure by modulating NAD+ metabolism and SIRT1 activity." Nature 458, no. 7241 (2009): 1056-1060.
- ↑Hardie, D. Grahame, Fiona A. Ross, and Simon A. Hawley. “AMPK: a nutrient and energy sensor that maintains energy homeostasis." Nature reviews Molecular cell biology 13, no. 4 (2012): 251-262.
- ↑Kaeberlein, Matt, Mitch McVey, and Leonard Guarente. “The SIR2/3/4 Complex and SIR2 Alone Promote Longevity in Saccharomyces Cerevisiae by Two Different Mechanisms.” Genes & Development 13, no. 19 (October 1, 1999): 2570–80.
- ↑Guarente, Leonard, Shin-ichiro Imai, Christopher M. Armstrong, and Matt Kaeberlein. “Transcriptional silencing and longevity protein Sir2 is an NAD-dependent histone deacetylase.” Nature 403, no. 6771 (February 17, 2000): 795–800. https://doi.org/10.1038/35001622.
- ↑ただし、Sirt1自体は、NcoR(Nuclear receptor co-Repressor 核内受容体補助抑制因子), SMRT(Silencing Mediator of Retinoid and Thyroid hormone receptor レチノイドと甲状腺ホルモン受容体のサイレンシング調停者)を介して、PPAR-γを抑制する。Picard, Frédéric, Martin Kurtev, Namjin Chung, Acharawan Topark-Ngarm, Thanaset Senawong, Rita Machado De Oliveira, Mark Leid, Michael W. McBurney, and Leonard Guarente. “Sirt1 promotes fat mobilization in white adipocytes by repressing PPAR-γ." Nature 429, no. 6993 (2004): 771-776.
- ↑Liang, Huiyun, and Walter F. Ward. “PGC-1α: a key regulator of energy metabolism." Advances in physiology education 30, no. 4 (2006): 145-151.
- ↑Terada, S., et al. “Effects of high-intensity intermittent swimming on PGC-1α protein expression in rat skeletal muscle." Acta physiologica scandinavica 184.1 (2005): 59-65.
- ↑Lin, Zhenghong, and Deyu Fang. “The Roles of SIRT1 in Cancer." Genes & cancer 4, no. 3-4 (2013): 97-104.
- ↑Salminen, Antero, and Kai Kaarniranta. “Regulation of the Aging Process by Autophagy.” Trends in Molecular Medicine 15, no. 5 (May 1, 2009): 217–24.

















ディスカッション
コメント一覧
まだ、コメントがありません